جدول تناوبی عناصر شیمیایی
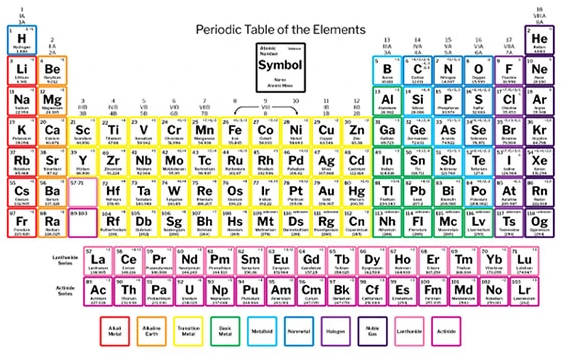
سازمان جهانی یونسکو میگوید: جدول تناوبی عناصر شیمیایی چیزی بیش از یک راهنما یا فهرستی از کل اتمهای شناختهشده در جهان است. این جدول اساسا دریچهای به روی جهان است که به گسترش درک ما از دنیای اطراف کمک میکند.
جدول تناوبی، یک لیست سازمانیافته از عناصر شیمیایی است که در آن، عناصر بر اساس افزایش عدد اتمی قرار گرفتهاند. وقتی عناصر شیمیایی به این شیوه مرتب میشوند، یک الگوی تکرارشونده تحت عنوان قانون تناوبی در خواص آنها مشاهده میشود. در واقع قانون تناوبی میگوید عناصر هر ستون، خواص مشابهی دارند. این نکته توسط دمیتری مندلیف در اواسط قرن 19 کشف شد که تاثیر قابل توجهی بر توسعه شیمی داشته است.
تاریخچه جدول تناوبی
در سال 1789، شیمیدان فرانسوی، آنتوان لاوازیه، سعی کرد عناصر را به دو دسته فلز و نافلز دستهبندی کند. پس از 40 سال، شیمیدان آلمانی، یوهان ولفگانگ دوبراینر شباهتهایی را در خواص فیزیکی و شیمیایی عناصر کشف کرد و آنها را در 3 گروه بر اساس افزایش وزن اتمی دستهبندی کرد.
در سال 1860، اولین کنفرانس بینالمللی شیمی در کارلسروهه، فهرست اصلاح شدهای از عناصر و جرم اتمی آنها منتشر کرد. جان نیولندز شیمیدان بریتانیایی اولین کسی بود که عناصر را بر اساس افزایش جرم اتمی مرتب کرد. او قانونی تحت عنوان قانون هشتتایی کشف کرد که طبق آن هر هشت عنصر، ویژگیهای مشابهی داشتند.
در سال 1869، دمیتری مندلیف روسی چارچوبی را ایجاد کرد که به جدول تناوبی مدرن شناخته شد. عناصر در این جدول بر اساس وزن اتمی دستهبندی شدند. او خواص برخی از عناصر کشف نشده را پیشبینی میکرد. تفاوت اصلی جدول تناوبی مدرن با جدول مندلیف در این است که در جدول مدرن عناصر بر اساس افزایش عدد اتمی و در جدول مندلیف، بر اساس افزایش وزن اتمی مرتب میشوند. اگرچه ترتیب عناصر در اکثر موارد یکسان است، اما تفاوتهایی هم وجود دارد.
اصطلاحات معروف جدول تناوبی

برای شناخت بهتر و راحتتر جدول مندلیف، بهتر است با اجزا و اصطلاحات آن آشنا شوید. در این جدول، هر مربع شامل حروف مربوط به نام شیمیایی عنصر و یک عدد است.
عدد اتمی
همان تعداد پروتونهای هسته میباشد که برابر با تعداد الکترونهای اتم است. اتم کوچکترین ذرات تشکیل دهنده هر عنصر است.
نماد شیمیایی
نمادی یک یا دو حرفی که برگرفته از مخفف نام رایج هر عنصر است. به عنوان مثال اکسیژن با O و طلا با Au نشان داده میشوند.

گروه جدول تناوبی
زمانی که شیمیدانهای اولیه برای خالص سازی سنگ معدن کار میکردند، با عناصر بیشتری آشنا شدند. آنها به این نتیجه رسیدند که عناصر مختلف را میتوانند بر اساس رفتارهای شیمیایی مشابه دستهبندی کنند. به عنوان مثال لیتیوم، سدیم و پتاسیم همگی براق هستند، گرما و الکتریسیته را به خوبی هدایت میکنند و خواص مشابهی دارند. بر همین اساس، گروه در جدول تناوبی به وجود آمد.
این گروهها همان ستونهای عمودی جدول هستند. عناصری که در یک ستون قرار دارند، در یک گروه مشابه هستند و اغلب آرایش الکترونی بیرونی آنها یکسان است. این بدان معنی است که آنها با عناصر دیگر به روشهای مشابه واکنش نشان میدهند. گروهها از چپ به راست و از 1 تا 18 نامگذاری میشوند. 6 مورد از اصلیترین گروهها به شرح زیر است:
- گروه 1: فلزات قلیایی
- گروه 2: فلزات قلیایی خاکی
- گروه 15: نیتروژن
- گروه 16: اکسیژن
- گروه 17: هالوژن
- گروه 18: گازهای نجیب
دوره جدول تناوبی
به ردیفهای افقی در جدول تناوبی که از چپ به راست میروند، دوره میگویند.
به این معنی که دارای خواص فیزیکی مشابهی هستند. در جدول تناوبی 7 دوره وجود دارد که دوره اول تنها 2 عنصر دارد. دوره دوم و سوم شامل 8 عنصر هستند. دورههای 4 و 5 از 18 عنصر و دورههای 6 و 7 از 32 عنصر تشکیل شدهاند.
عنصرهای شیمیایی به چند دسته تقسیم میشوند؟
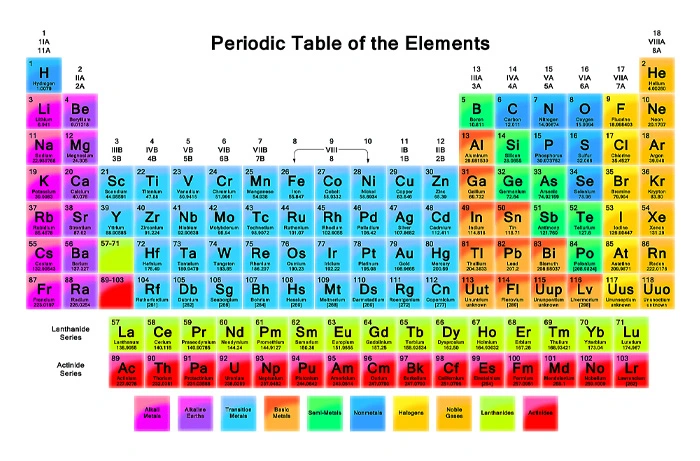
به طور کلی تقسیمبندی عناصر در جدول تناوبی به صورت زیر است:
فلزات
این دسته از عناصر خود به موارد زیر تقسیم میشوند:
فلزات قلیایی
بیشتر عناصر گروه 1 جدول، در این دسته قرار میگیرند. این فلزات براق و نرم هستند. به طوریکه میتوان آنها را با چاقو برش داد. همچنین از واکنشپذیری بالایی برخوردارند و ممکن است در اثر تماس با آب منفجر شوند. این دسته با لیتیوم شروع و با فرانسیوم تمام میشود.
فلزات قلیایی خاکی
این دسته از فلزات، در واقع همان گروه 2 جدول تناوبی است که از بریلیم تا رادیوم را شامل میشود. هر یک از این عناصر، 2 الکترون در بیرونیترین سطح انرژی خود دارند و به ندرت به تنهایی در طبیعت یافت میشوند. واکنشپذیری این گروه نسبت به فلزات قلیایی کمتر و سرعت واکنش آنها کندتر است؛ همچنین گرمای کمتری تولید میکنند.
فلزات واسطه
به طور کلی عناصری که اوربیتال d آنها در جدول تناوبی در حال تکمیل است، با عنوان فلزات واسطه شناخته میشوند. این عناصر در بدنه جدول قرار دارند، شامل گروههای 3 تا 12 و همان فلزاتی هستند که با شنیدن این کلمه، در ذهن شما به تصویر کشیده میشوند؛ مانند طلا، آهن، نقره و …. برخی از ویژگیهای آنها عبارتند از:
- سخت
- چکشخوار
- براق
- دارای رسانایی خوب برای گرما و الکتریسیته
- نقطه ذوب و جوش بالا
- چگالی بالا
فلزات واسطه داخلی

در این دسته از فلزات، اوربیتال f و d در حال پر شدن است. این دسته از فلزات، خود به دو دسته مجزا تقسیم میشوند که جدا از جدول و در دو ردیف پایین قرار گرفتهاند:
لانتانیدها
این دسته، از 15 عنصر فلزی با عدد اتمی 57 تا 71 تشکیل میشود. لانتانیدها با لانتانیم شروع و با لوتسیم تمام میشوند. رنگ آنها سفید مایل به نقرهای است. اگر لانتانیدها در معرض هوا قرار بگیرند، تغییر رنگ داده و کدر میشوند. اصلیترین ویژگیهای این فلزات در ادامه معرفی شدهاند:
- نرم هستند و سختی آنها به ترتیب افزایش مییابد.
- مقاومت نسبتا بالایی دارند.
- لانتانیدها از قانون Oddo-Harkins پیروی میکنند. این قانون میگوید عناصر با اعداد فرد نسبت به همسایگان خود با اعداد زوج فراوانی کمتری دارند.
- دارای خواص مغناطیسی هستند.
- نقطه ذوب بسیار بالایی دارند.
- اگر با اکسیژن یا نیتروژن ترکیب شوند، شکننده میشوند.
اکتینیدها
اکتینیدها با اکتینیم شروع شده و با لارنسیم خاتمه مییابد. این دسته، از عنصر 89 شروع شده و تا 103 ادامه دارد. این نوع از فلزات واسطه داخلی به مقدار زیادی در طبیعت وجود ندارند و تنها دو عنصر توریم و اورانیوم به طور طبیعی و به مقدار قابل توجهی در زمین یافت میشوند. جالب توجه است که تمامی آنها رادیو اکتیو هستند و میزان پرتوزایی بالایی دارند.
برخی اکتینیدها مانند اورانیوم و توریم از زمین استخراج میشوند و عناصری مانند پلوتونیوم در آزمایشگاه سنتز میشوند. خواص اکتینیدها، آنها را از دیگر عناصر جدول تناوبی متمایز میسازد. ویژگیهای برجسته این فلزات عبارتند از:
- نقرهای رنگ هستند.
- دارای انعطافپذیری و شکلپذیری بالایی هستند.
- چگالی و وزن بالاتری نسبت به دیگر فلزات دارند.
- اگر در معرض هوا قرار بگیرند، به سرعت دچار زنگزدگی و یا خوردگی میشوند.
- اکتینیدها در صورت رقیق شدن با اسیدها به گاز تبدیل میشوند.
فلزات پس واسطه
گروه 13 و 17 به همراه آلومینیوم، گالیم، ایندیم، تالیم، قلع، سرب و بیسموت فلزات پس واسطه را تشکیل میدهند. این عناصر، خواص فلزات واسطه را دارند اما نسبت به آنها نرمتر هستند. همچنین رسانایی این عناصر ضعیفتر است.
متالوئیدها (شبه فلزات)
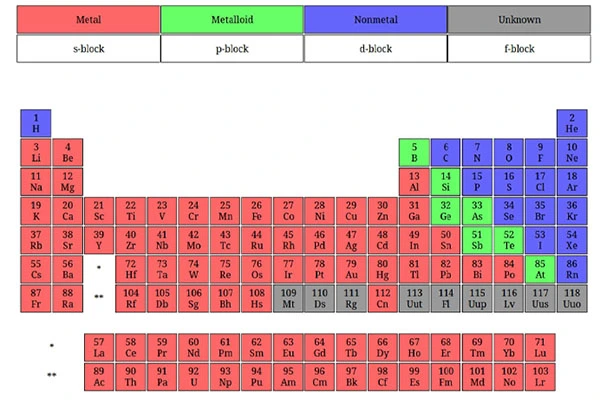
دستهای از عناصر هستند که نه در دسته فلزات قرار میگیرند و نه در نافلزات، زیرا ویژگیهای آنها مشابه هیچ یک از این دو گروه نیست. در واقع متالوئیدها در حد وسط این دو دسته قرار دارند. میتوان این دسته را نیمه فلزات نیز نامید. این عناصر در امتداد زیگزاگ یا پله عناصر در جدول تناوبی در قسمت بالای سمت راست متمرکز شدهاند. برخی از متالوئیدها در ادامه معرفی میشوند:
سیلیسیم
سیلیسیم خالص در طبیعت، واکنشپذیری بالایی دارد. مشتقات این عنصر را میتوان در ماسهها، سنگها و خاکها پیدا کرد. این عنصر رسانایی الکترونیکی ضعیفی دارد و از آن بیشتر در ساخت آلیاژها، شیشه، سرامیک و لعاب استفاده میشود.
- یک متالوئید معمولی است که مشابه فلزات، ظاهری درخشان دارد.
- شکننده است.
- به طور گسترده در تراشههای کامپیوتری کاربرد دارد.
بور
کریستالی فوقالعاده سخت است که رنگ مشکی براق دارد و برای حیوانات غیرسمی است. جالب است بدانید که گیاهان برای رشد خود، به این متالوئید نیاز دارند. از بور به عنوان افزودنی برای سختتر شدن فولاد و شیشه یا حتی در ترکیبات حشرهکشها استفاده میشود.
- بور در شکل کریستالی خود، غیرفعال است.
- در دمای اتاق، رسانای الکتریکی ضعیفی است؛ اما در دماهای بالا رسانایی خوبی دارد.
- در طبیعت آزاد نیست و به صورت اسید ارتوبوریک در برخی از مواد آتشفشانی یافت میشود.
آنتیموان
این عنصر دارای عدد اتمی 51 است که در آلیاژها و رنگها استفاده میشود.
- ظاهری مشابه فلزات و رنگی سفید مایل به نقرهای دارد.
- سخت و در عین حال شکننده است.
- رسانای الکتریکی ضعیف است اما در صورتی که دمای آن افزایش پیدا کند، رسانایی آن بهبود مییابد.
آرسنیک
این شبه فلز تا 3 پیوند کووالانسی توانایی ترکیب شدن را دارد. از آرسنیک برای سخت شدن سرب و سایر آلیاژهای فلزی استفاده میشود.
- در هوای خشک، پایدار است اما در هوای مرطوب شروع به کدر شدن میکند.
- اگر در معرض گرما قرار بگیرد، به تری اکسید آرسنیک تبدیل میشود و بویی مشابه بوی سیر تولید میکند.
- اگر تا دمای 615 درجه سانتیگراد گرما ببیند، از فاز جامد به گاز تبدیل میشود.
نافلزات
این دسته، از گازهای بیرنگ تا جامدات براق و نسوز که نقطه ذوب بالایی دارند، تشکیل میشود. کربن، نیتروژن، فسفر، اکسیژن، گوگرد و سلنیوم به همراه هیدروژن این دسته را تشکیل میدهند. برخی از مشخصات فیزیکی آنها:
- درخشندگی فلزات را دارند.
- شکنندگی آنها بالا است.
- چگالی آنها از فلزات کمتر و از غیرفلزات بیشتر است.
- رسانایی آنها تحت تاثیر دما و ناخالصی متغیر است.
گازهای نجیب
گازهای نجیب یا بیاثر، بیرنگ و بیبو هستند و در گروه 18 جدول تناوبی قرار دارند. منظور از بیاثر این است که تمایلی به واکنش شیمیایی با دیگر عناصر ندارند و غیرقابل اشتعال هستند.
گازهای نجیب عبارتند از:
- هلیوم
- نئون
- آرگون
- کریپتون
- زنون
- رادون
- اوگانسون
تمامی این عناصر در دما و فشار معمولی گاز هستند اما از آنجا که اتمهای کافی از اوگانسون وجود ندارد، حالت دقیق آن مشخص نیست. بیشتر دانشمندان معتقدند این عنصر مایع یا جامد است.
آرگون سومین گاز فراوان در جهان محسوب میشود. در حالی که نئون، کریپتون، هلیوم و زنون عناصری کمیاب در نظر گرفته میشوند.
بار عناصر جدول تناوبی
منظور از بار در جدول تناوبی عناصر، همان بار یونی آنها میباشد. در واقع به تفاوت بین تعداد الکترونها (بار منفی) و تعداد پروتونها (بار مثبت) در یک اتم، بار گفته میشود. بار یک اتم در حالت طبیعی برابر با 0 است. این بار هستهای موثر از چپ به راست در جدول تناوبی افزایش مییابد. در زیر با بار گروهای جدول تناوبی آشنا میشویم:
- گروه فلزات قلیایی: 1+
- گروه فلزات قلیایی خاکی: 2+
- گروه هالوژن: 1-
- گروه گازهای نجیب: 0
عناصر فلزی در جهت تبدیل شدن به گاز نجیب، الکترونهای خود را از دست میدهند؛ در حالی که نافلزات برای رسیدن به ساختار گاز نجیب الکترون به دست میآورند. وقتی یک اتم، الکترون از دست میدهد، تعداد بار آن مثبت میشود و بر عکس، با جذب الکترون، بار آن منفی خواهد شد.
روندهای تناوبی در جدول مندلیف
الگوهایی در جدول تناوبی عناصر شیمیایی وجود دارند که باعث تغییر در خواص فیزیکی و شیمیایی عناصر در طول دورهها و گروهها میشوند. در واقع این روندها بر اساس تغییر در ساختار الکترونی و بار موثر هسته در عناصر شیمیایی به وجود میآیند. در ادامه به طور خلاصه به معرفی این الگوها میپردازیم:
روند الکترونگاتیوی
این روند در واقع به توانایی اتم در جذب الکترون و تشکیل پیوند کووالانسی اشاره دارد. لایه ظرفیت عناصری که در سمت چپ جدول تناوبی قرار گرفتهاند، به گونهای است که به انرژی کمتری برای از دست دادن الکترون نیاز دارد. در نتیجه روند الکترونگاتیوی در جدول تناوبی از چپ به راست افزایش پیدا میکند.
همچنین در هر گروه، این الگو از بالا به پایین روندی کاهشی دارد؛ زیرا عدد اتمی عناصر افزایش مییابد و به دنبال آن فاصله بین الکترونهای ظرفیت و هسته بیشتر میشود.
روند خاصیت فلزی
خاصیت فلزی به معنای تمایل اتم به از دست دادن الکترون است. این ویژگی عناصر در هر دوره از راست به چپ به دلیل افزایش جاذبه بین هسته و الکترون ظرفیت، کاهش پیدا میکند. همچنین خاصیت فلزی عناصر در گروههای جدول از بالا به پایین افزایش مییابد؛ زیرا اندازه اتمها بیشتر میشود.
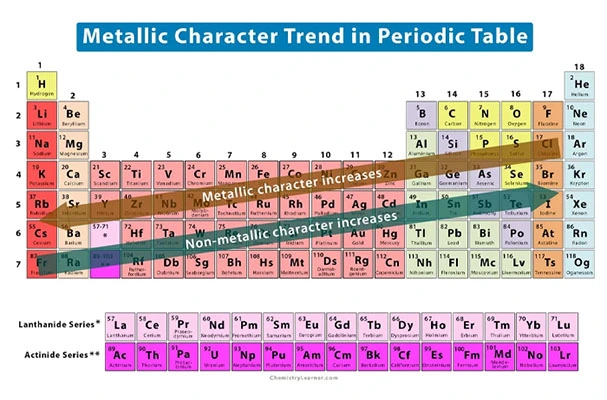
روند انرژی یونش
به مقدار انرژی که هنگام جدا کردن الکترون از یک اتم خنثی مورد نیاز است، انرژی یونش میگویند. در هر دوره، از چپ به راست این انرژی افزایش پیدا میکند؛ این در حالی است که در گروههای جدول از بالا به پایین انرژی یونش کاهشی است.
روند الکترونخواهی
منظور از این روند، تمایل و ظرفیت یک اتم برای جذب الکترون است. روند الکترون خواهی مفهومی کمی دارد؛ در حالی که الگوی الکترونگاتیوی دارای مفهومی کیفی است. وقتی مقدار الکترونخواهی یک اتم منفی است، تمایل آن به پذیرش الکترون بیشتر است. در جدول تناوبی در هر دوره از چپ به راست، این روند افزایشی و در هر گروه از بالا به پایین کاهشی است.
روند شعاع اتمی
منظور از شعاع اتمی، فاصله بین هسته تا مرز ابرالکترونی اتم میباشد. در هر دوره از جدول تناوبی میزان شعاع اتمی کمتر میشود؛ به این معنا که هسته، الکترونها را با شدت بیشتری میپذیرد. همچنین در هر گروه از بالا به پایین این روند افزایش مییابد.
روند نقطه ذوب
همانطور که میدانید، منظور از نقطه ذوب، دمایی است که یک ماده تغییر حالت داده و به مایع تبدیل میشود. پیوند قوی بین اتمها باعث بالا رفتن این نقطه میشود. به طور کلی در جدول تناوبی فلزات نقطه ذوب بالاتری دارند.
تقسیمبندی عناصر بر اساس اوربیتالها
در جدول تناوبی عناصر، اتمها بر اساس ویژگیهای الکترونی خود و با توجه به نوع اوربیتالهای پرشده در لایههای الکترونیشان به چهار بلوک اصلی s،p ،d و f تقسیم میشوند.
قبل از اینکه به بررسی بلوکهای مختلف جدول بپردازیم، لازم است که درک مختصری از اوربیتالهای اتمی داشته باشیم. اوربیتالهای اتمی، نواحی فضای اطراف هسته اتم هستند که احتمال یافتن الکترون در آنها زیاد است. هر اوربیتال دارای شکل خاصی میباشد و میتواند حداکثر دو الکترون را در خود جای دهد.
- اوربیتال s: شکل کروی دارد و در هر لایه انرژی فقط یک اوربیتال s وجود دارد.
- اوربیتال p: شکل دمبل دارد و در هر لایه انرژی از لایه دوم به بعد، سه اوربیتال p وجود دارد.
- اوربیتال d: شکل پیچیدهتری دارند و در هر لایه انرژی از لایه سوم به بعد، پنج اوربیتال d وجود دارد.
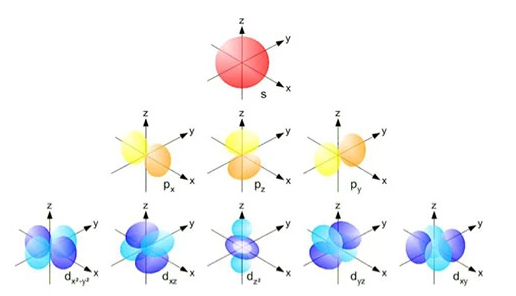
اوربیتال f: شکل بسیار پیچیدهتری دارند و در هر لایه انرژی از لایه چهارم به بعد، هفت اوربیتال f وجود دارد.
بلوکهای جدول تناوبی
در ادامه به توضیح هر بلوک و ویژگیهای آنها میپردازیم:
بلوک s
عناصری که الکترونهای آخرین لایه آنها در اوربیتالهای s قرار دارند، در این بلوک جای میگیرند. اوربیتال s میتواند حداکثر دو الکترون را در خود جای دهد، بنابراین گروههای این بلوک تنها دو ستون دارند:
گروه 1 که شامل فلزات قلیایی (مانند لیتیم و سدیم) میباشد و گروه 2 که شامل فلزات قلیایی خاکی (مانند منیزیم و کلسیم) است. هلیوم نیز در این بلوک قرار میگیرد. عناصر بلوک s به دلیل تعداد کم الکترونهای موجود در لایه بیرونی، تمایل زیادی به واکنشپذیری دارند و به سادگی الکترون از دست میدهند. ویژگیهای این عناصر به شرح زیر است:
- به طور کلی فلز هستند.
- بسیار واکنشپذیرند.
- شعاع اتمی بزرگی دارند.
- انرژی یونش کمی دارند.
- دارای الکترونگاتیوی کمی هستند.
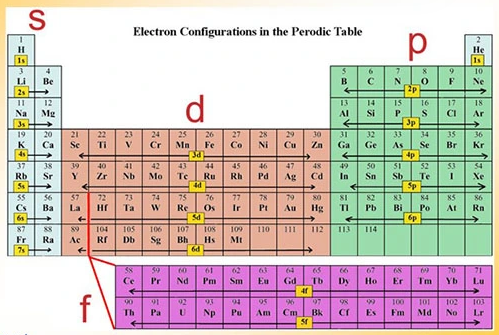
بلوک p
عناصری که الکترونهای آخرین لایه آنها در اوربیتالهای p قرار دارند، در این بلوک جای دارند. اوربیتال p میتواند تا 6 الکترون را در خود جای دهد، بنابراین این بلوک شامل شش گروه (13 تا 18) میباشد. در ادامه ویژگیهای این بلوک را میبینیم:
- شامل گروههای بور، کربن، نیتروژن، اکسیژن، فلوئور، کلر و گازهای نجیب است.
- فلزات، نافلزات و شبه فلزات را در بر میگیرد.
- این عناصر خواص متنوعی دارند.
- الکترونگاتیوی آنها از چپ به راست در یک دوره افزایش مییابد.
نافلزات بویژه گروه هالوژنها، تمایل به دریافت الکترون دارند و واکنشپذیری بالایی از خود نشان میدهند، در حالی که گازهای نجیب با داشتن لایه کامل الکترونی تقریبا بدون واکنش هستند.
بلوک d
عناصری که الکترونهای آخرین لایه آنها در اوربیتالهای d قرار میگیرند، در این بلوک هستند. اوربیتال d میتواند تا 10 الکترون را در خود جای دهد، بنابراین این بلوک شامل ده گروه (3 تا 12) است.
این عناصر به دلیل ساختار الکترونی خاص، دارای ویژگیهای رنگی، مغناطیسی و کاتالیستی خاص هستند، همچنین از ویژگیهای مشترک آنها میتوان به توانایی تشکیل پیوندهای فلزی اشاره کرد. سایر ویژگیهای این عناصر به شرح زیر است:
- شامل فلزات واسطه یا عناصر انتقالی مانند آهن، مس و طلا میشود.
- خواص مغناطیسی و کاتالیزوری خاصی دارند.
- تشکیل ترکیبات رنگی میدهند.
بلوک f
عناصری که الکترونهای آخرین لایه آنها در اوربیتالهای f قرار دارند، در این بلوک جای میگیرند. اوربیتال f میتواند تا 14 الکترون را در خود جای دهد، بنابراین این بلوک شامل چهارده عنصر در هر دوره است: لانتانیدها (عناصر 58 تا 71) و اکتینیدها (عناصر 90 تا 103).
لانتانیدها و اکتینیدها به ترتیب در دورههای ششم و هفتم جدول قرار دارند و به نام عناصر خاکی کمیاب نیز شناخته میشوند. عناصر بلوک f معمولاً دارای خواص مغناطیسی و کاتالیستی بوده و اغلب پرتوزا هستند.
اهمیت تقسیمبندی بر اساس اوربیتال
درک بهتر ساختار اتم: این تقسیمبندی به ما کمک میکند تا ساختار الکترونی اتمها را بهتر درک کنیم.
پیشبینی خواص عناصر: با دانستن بلوکی که یک عنصر در آن قرار دارد، میتوان تا حد زیادی خواص شیمیایی و فیزیکی آن را پیشبینی کرد.
توجه داشته باشید که این تقسیمبندی به طور کلی برای درک بهتر خواص عناصر استفاده میشود، اما در برخی موارد، استثناهایی نیز وجود دارد. برای درک کاملتر خواص عناصر، باید به عوامل دیگری مانند اثر حفاظتی الکترونها و قاعده هوند نیز توجه کرد.
10 واقعیت جالب درباره جدول تناوبی

برخی از نکات جالب توجه درباره جدول تناوبی به شرح زیر است:
- اگرچه اغلب، دمیتری مندلیف را به عنوان مخترع جدول تناوبی مدرن میشناسند، اما جدول او اولین جدولی نبود که عناصر را بر اساس ویژگیهای دورهای بررسی کرد.
- در جدول تناوبی حدود 94 عنصر موجود در طبیعت قرار دارد. بقیه عناصر، ساخته دست بشر است.
- عنصر تکنسیوم اولین عنصری بود که به صورت مصنوعی ساخته شد. تکنسیوم سبکترین عنصری است که فقط ایزوتوپهای رادیواکتیو دارد.
- اتحادیه بینالمللی شیمی محض و کاربردی، در دسامبر سال 2018 آخرین نسخه جدول تناوبی را بازبینی و تصویب کرد.
- بیشتر عناصر این جدول را فلزات تشکیل میدهند.
- جدول تناوبی کنونی 118 عنصر دارد. دانشمندان در حال کشف عناصر 119 و 120 هستند؛ بنابراین ظاهر این جدول در حال تغییر است. احتمالا عنصر 119 زیر فرانسیم و عنصر 120 دقیقا زیر رادیوم قرار میگیرد.
- شاید فکر کنید اتمهای یک عنصر با افزایش عدد اتمی آنها، بزرگتر میشوند، اما همیشه این اتفاق نمیافتد؛ زیرا اندازه یک اتم با قطر پوسته الکترونی آن تعیین میشود.
- به دلیل ماهیت چرخهای ایجاد شده توسط تناوب که نام جدول از آن گرفته شده است، برخی شیمیدانان ترجیح میدهند جدول مندلیف را به صورت دایرهای تجسم کنند.
منبع: پارس هوا

